Exercice 1: Chimie organique Epreuve de chimie au probatoire D et C 2013
Exercice 1 : CHIMIE ORGANIQUE (8 pts)
l-Donner, en nomenclature systématique. le nom de chacun des composés suivants :

(i)
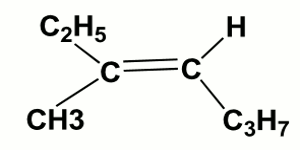
(ii)
2-A propos des pétroles et des gaz naturels:
2.1-Donner les deux étapes de la distillation fractionnée du pétrole. ( 0,5 pt )
-Citer, dans chaque cas, deux exemples de coupes obtenues. ( 0,5 pt )
2.2-Citer deux exemples d'impuretés contenues dans le gaz naturel. ( 0,25 pt )
3– Le benzène est le plus simple des composés aromatiques.
3-1-Qu’est-ce qu'un composé aromatique ? (0,5pt)
3.2-Donner la formule développée du benzène. 0,5 pt )
-Préciser la longueur de la liaison carbone-carbone et la valeur des angles valenciels. (0,5 pt)
3.3-Sous une hotte aspirante, en absence de lumière et en présence de catalyseur tel que le diiode I2, la réaction du dichlore sur le benzène est une substitution.
3-3-1-Qu’est-ce qu'une substitution ? (0,25 pt)
3.3.2-Ecrire les équations-bilan des quatre premières substitutions. (1 pt)
-Préciser les noms des produits organiques obtenus. (0,5 pt)
- Représenter et nommer tous les isomères du produit organique de la deuxième substitution. (0,75 pt)
3.3.3-Que se passerait-il si on fait réagir le benzène et le dichlore dans une salle de classe non aérée et en présence de la lumière solaire ? (0,5 pt)
3.4- En présence de catalyseur (peroxyde de benzoyle), le styrène de formule C6H5-CH=CH2, subit une réaction de polymérisation.
3.4.1-Qu’est-ce qu'une réaction de polymérisation ? (0,25 pt)
3.4.2-Ecrire l'équation-bilan de la réaction précédente. (0,5 pt)
-Préciser le nom du produit formé. (0,25pt)
- Déterminer le degré de polymérisation sachant que le polymère obtenu a une masse de 3,12 kg. (0,75 pt)
- Citer deux exemples d'application usuelle de ce produit. . (0,25 pt )
Données : Masses molaires atomiques (en g/mol) : C :12 ; H :1.
Exercice 2: Oxydoreduction et engrais Epreuve de chimie au probatoire D et C 2013
Exercice 2 : OXYDORÉDUCTION ET ENGRAIS (8 pts)
1. OXYDORÉDUCTION ( 5 pts)
1.1 Qu’est-ce qu'un réducteur ? Une réaction d’oxydoréduction? (0,5pt)
1.2 On veut déterminer les potentiels standards des couples Ag+/Ag et Mg2+/Mg, Pour cela, on réalise deux piles :
-Pile-1 : constituée d'une lame de cuivre plongeant dans une solution de sulfate de cuivre et d'une lame d'argent plongeant dans une solution de sulfate d'argent. La f.é.m. de cette pile est E1 = 0,46 V, et son pôle positif est la lame d'argent.
-Pile-2 : constituée d'une lame de cuivre plongeant dans une solution de sulfate cuivre et d'une lame de magnésium plongeant dans une solution de sulfate de magnésium. La f.é.m. de cette pile est E2 = 2,71 V et son pôle positif est la lame de cuivre.
1.2.1-Indiquer, pour chaque pile, l’oxydant le plus fort et le réducteur le plus fort. (1 pt )
1.2.2-Ecrire, pour chaque pile, l'équation-bilan des réactions d’oxydoréduction. 1 pt
1.2.3 -Déterminer les potentiels standards des couples Ag+/Ag et Mg2+/Mg. Sachant que celui du couple Cu2+/Cu est de 0,34 V. ( 1 pt )
1.2.4 -Classer les trois couples mis en jeu par ordre de pouvoir oxydant croissant. ( 0,5 pt)
1.3-Utiliser les nombres d'oxydation pour équilibrer l'équation-bilan suivante :
H3O++NO−3 +H2S→ NO+S+H2O
Engrais Epreuve de chimie au probatoire D et C, E 2013
2. ENGRAIS : (3 pts)
Pour accroître sa production en maïs de 83%, un cultivateur a recours à un engrais ternaire de formule 50-25-25.
2.1-Qu’est-ce qu'un engrais ternaire ? (0.25 pt )
2.2-Que signifient les nombres de cette formule ? (0, 75 pt)
2.3-Quel rôle joue chacun des éléments N,P,K dans la plante ? (0, 75 pt)
2.4-L’année suivante, faute de moyen, le cultivateur qui en plus élève du bétail, décide d'utiliser l'humus qui est à portée de main.
2-4.1-Qu’est-ce que l'humus ? (0,25 pt)
2.4.2-L’humus enrichit-il la plante des mêmes éléments fertilisants ?
Justifier en une ligne. (0,75 pt)
2.4.3-Quel est le plus grand avantage qu'offre l'utilisation de l'humus ? ( 0,25 pt )
Exercice 3 : type expérimental Epreuve de chimie au probatoire D et C 2013
Exercice 3 : TYPE EXPÉRIMENTAL (4pts)
- Pour éviter l'oxydation du vin, les viticulteurs y ajoutent souvent du dioxyde de soufre SO2. Ce dernier est alors dosé par une solution de diiode à 1/125 moL/L.
On introduit dans un erlenmeyer 20 mL de vin à doser, un peu d'acide sulfurique pour acidifier le milieu et quelques gouttes d’empois d'amidon qui se colore en bleu en présence de diiode. L’équivalence est obtenue pour un volume V = 7,5 mL de diiode versé.
1-Faire le schéma du dispositif expérimental de dosage. . . 0,75 pt
2-Quelle verrerie utilise-t-on pour prélever l'acide ?
-Donner un exemple de précaution à prendre pour utiliser l'acide. ( 0,5 pt )
3-Comment repère-t-on l'équivalence au cours de ce dosage ? ( 0,5pt )
4-Ecrire l'équation-bilan de la réaction de dosage. (0,75 pt )
5-Déterminer la concentration molaire en S02 dans ce vin. (0,75 pt)
6- Dire, en justifiant, si le résultat précédent est conforme à la législation qui prévoit que la teneur en S02 d'un vin blanc est limitée à 210 mg/L. (0,75 pt)
Données : Masses molaires (en g/mol) : S :32; O :16.
-Potentiels standards d’oxydoréduction : EO(I2/I−)=0,62V, EO(SO2−4/SO2)=0,17V

