Partie A : Évaluation des ressources
Exercice 1 : Vérification des savoirs / 8 points
1. Définir : Acide faible, Réaction d’oxydoréduction. 2pts
2. Choisir la réponse exacte:
2.1 Le pH d'une solution neutre est 7 : 1 pt
a) à 0 °C ;
b) à 25 °C .
c) Quelle que soit la température.
2.2 Dans une pile électrochimique de type Daniell, le pôle positif est l'électrode constituée du métal: 1 pt
a) le plus réducteur ;
b) le moins réducteur.
3. Donner les trois caractéristiques d'une réaction entre un chlorure d'acyle et un alcool. 2 pts
4. Donner deux précautions à prendre lorsqu'on manipule l'acide chlorhydrique. 1 pt
Exercice 2 : Application des savoirs / 8 points
1. Calculer la concentration d'une solution de monoacide fort dont le pH est 4.
2. Équilibrer la demi-équation électronique du couple \(C{r_2}O_7^{2 - }/C{r^{3 + }}\) :
\(C{r_2}O_7^{2 - } + ...{H_3}{O^ + }\) \( \Leftrightarrow ...C{r^{3 + }} + ...{H_2}O\)
3. En utilisant les formules semi-développées, écrire l'équation-bilan de la réaction entre l'acide propénoïque et le propan-1-ol. Nommer le composé obtenu. 2pt
4. On mélange l'acide éthanoïque avec une solution aqueuse de soude, les couples acide-base présents dans le milieu sont : \(C{H_3}COOH/\) \(C{H_3}CO{O^ - }\), \({H_2}O/H{O^ - }\), \({H_3}{O^ + }/{H_2}O\).
On donne leurs pKa respectifs : 4,8 ; 14 et 0.
4.1- Placer sur une échelle de pKa les couples en présence par acidité croissante. 1 pt
4.2- Écrire l'équation-bilan de la réaction entre l'acide éthanoïque et la soude. 1 pt
4.3- Peut-on utiliser cette réaction pour un dosage. Justifier ? 1 pt
Exercice 3 : Utilisation des savoirs / 8 points
1. On veut protéger la coque d'un bateau en fer par une méthode qui consiste à placer sur la coque du bateau des plaques, qualifiées d'anodes sacrificielles, d'un métal plus réducteur que le fer. On dispose pour cela du zinc et du cuivre.
On donne \({E^o}\left( {C{u^{2 + }}/Cu} \right) = + 0,34V\), \({E^o}\left( {Z{n^{2 + }}/Zn} \right) = - 0,76V\) et \({E^o}\left( {F{e^{2 + }}/Fe} \right) = - 0,44V\)
1.1) Classer les métaux en présence par pouvoir réducteur croissant. 1.5 pt
1.2- Choisir le métal approprié pour protéger la coque du bateau. 1,5 pt
2. La formule générale d'une famille de composés peut s'écrire \({C_n}{H_{2n}}O\), \(n\) entier naturel non nul. Un élément A de cette famille contient en masse 22,2 % d'oxygène.
2.1. Déterminer la masse molaire du composé A. 2 pts
2.2. En déduire sa formule brute. 3 pts
Partie B : Évaluation des compétences (16 points)
Dans le cadre d'une olympiade de chimie, Le Jury a préparé une solution d'un acide carboxylique de formule \({C_n}{H_{2n}}{O_2}\), en dissolvant une masse m = 3,73 g de cet acide dans un volume V = 1 L d'eau. Puis, un volume Va = 20,0 mL a été prélevé et dosé par une solution de soude (\(N{a^ + } + O{H^ - }\)) de concentration \({C_b} = 8,00 \times {10^{ - 2}}\) mol/L. Les résultats du dosage sont donnés ci-dessous :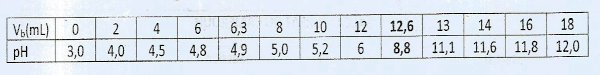 pH à l'équivalence : 8,8.
pH à l'équivalence : 8,8.
On donne en g/mol: C (12) ; H (1) ; 0 (16).
En le servant des informations ci-dessus, de tes connaissances propres et en t’appuyant sur un raisonnement scientifique, aide les candidats de cette olympiade à accomplir les deux tâches suivantes :
1- identifier, par la détermination de sa formule développée, l'acide carboxylique dosé. 8 pts
2- Décrire, de façon bien précise, comment on obtient une solution tampon à partir de cette solution acide et la solution de soucie utilisée. 8 pts
Les démarches de résolution adoptées devront s'accompagner de l’écriture des équations ou des formules, des calculs appropriés et, lorsque cela est nécessaire, de la précision sur le matériel à utiliser et sur les volumes de solutions à prélever.

