Partie A : Évaluation des ressources : 24 points
Exercice 1 : Vérification des savoirs : 8pts
1. Définir : oxydation ; Monobase forte. 2ptx2
2. Une solution donc le pH varie peu par ajout modéré d’acide, de base ou d’eau est : 1pt
a) Une solution d’acide fort ;
b) Une solution tampon ;
c) Une solution de base faible
3. Lors du dosage entre un acide fort et une base faible, à 25°C, le pH de la solution à l’équivalence est : 1pt
a) pH = 7 ;
b) pH >7 ;
c) pH ˂7
4. La réaction inverse de l’hydrolyse des esters est la réaction d’estérification VRAI ou FAUX ? 1pt
5. L’oxydation ménagée d’un alcool primaire, l’oxydant étant en défaut conduit à la formation d’un acide carboxylique. VRAI ou FAUX ? 1pt
Exercice 2 : Application des savoirs : 8pts
1. Donner les formules semi-développées des composés de noms : 1x2pt
a) Acide 2- méthylpentanoique
b) 2,2- diméthylhexan-3-ol
2. Écrire les formules semi-développées et les noms des isomères de l’alcool de formule brute C3H8OC3H8O 0,5ptx4
3. On mélange à un volume Va d’une solution de chlorure d’ammonium (NH4Cl) de concentration Ca = 0,06 mol/L, un volume Vb d’une solution d’hydroxyde de sodium (NaOH) de même concentration de façon à obtenir 150 ml d’une solution de pH = 9,2.
3.1 Comment appelle-ton ce type de solution ? 1pt
3.2 Donner une importance de cette solution. 1pt
3.3 Déterminer les volumes Vb et Va nécessaires à la préparation de cette solution. 2pt
On donne pKaNH+4/NH3=9,2
Exercice 3 : Utilisation des savoirs : 8pts
On réalise une pile plomb-cuivre en associant une lame de cuivre plongeant dans une solution de sulfate de cuivre (II) et une lame de plomb plongeant dans une solution de sulfate de plomb, et les deux reliés par un pont salin. On donne les potentiels redox standard suivants : Eo(Pb2+/Pb)=−0,13V et Eo(Cu2+/Cu)=0,34V
1. Quel est le métal qui occupe le pole positif de cette pile ? 1pt
2. Donner le schéma de la pile en précisant la polarité, le sens du courant et celui des électrons ? 2pt
3. Donner la représentation conventionnelle de cette pile ? 1pt
4. Écrire l’équation-bilan de fonctionnement de cette pile. 1pt
5. Préciser le réducteur et l’oxydant. 1pt
6. Calculer la f.é.m. de cette pile. 2pts
Partie B : Évaluation des compétences : 16 pts
Situation problème :
Sur l’emballage d’un détartrant pour caféine contenant de l’acide sulfamique de formule brute NH2−SO3H, monoacide que l’on pourra noter AH, on peut lire que le degré de pureté en acide sulfamique est de 80 %.
Votre oncle achète un sachet de se détartrant et vous l’apporte dans votre laboratoire ou vous exercez comme laborantin, en vue de s’assurer de la pertinence de l’information ainsi portée.
Pour réaliser ce travail, vous introduisez dans un bécher contenant de l’eau distillée, m = 0,26 g de détartrant et vous suivez au pH-mètre l’évolution du pH lors de l’addition d’une solution d’hydroxyde de sodium (NaOH) de concentration Cb = 0,2 mol/l.
Les résultats obtenus vous ont donné la courbe du document à remettre avec sa copie, Vb étant le volume de soude versé.
A partir d’une démarche scientifique et après exploitation des données ci-dessus :
1 : Décrire le protocole expérimental permettant d’obtenir les valeurs ayant permises de tracer la courbe ci-dessous. 8pt 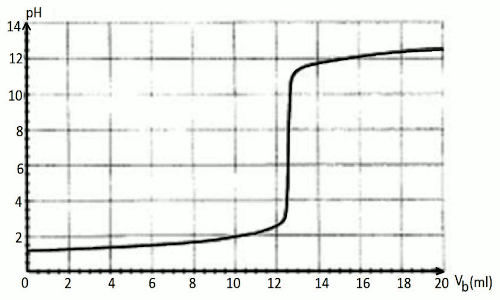 2 : Dire si l’information marquée sur le sachet de détartrant est fiable. 8pt
2 : Dire si l’information marquée sur le sachet de détartrant est fiable. 8pt
On donne en g/mol : S = 32 ; N = 14 ; O = 16 ; H = 1


