Masses molaires atomiques (g/mol) : C : 12 ; H : 1 ; O : 16 ; N : 14 ; Cr :52 ; K : 39.
Partie A : Évaluation des ressources / 24 points
Exercice 1 : Vérification des savoirs/ 8 points
1-1- Définir : Point d’équivalence ; Mélange racémique. 2 pt
1-2. QCM : Choisir la bonne réponse parmi celles proposées ci-dessous 2pt
1-2.1. Deux énantiomères sont des isomères :
a) de constitution
b) de configuration
c) de conformation
1-2.2. En solution aqueuse, le zwitterion est majoritaire devant l’anion et le cation :
a) acide
b) neutre
c) basique.
1-2.3. Le pH d’une solution d’hydroxyde de sodium de concentration \(C\) est :
a) \(pH = 14 + \log C\)
b) \(pH = 14 - \log C\)
c) \(pH = - \log C\)
1-2-4-L’oxydation ménagée d’un alcool tertiaire avec un oxydant aboutit à :
(a) : une cétone ;
(b) : un acide carboxylique;
(c): aucune réponse n’est juste.
1-3-Donner un exemple de réaction lente (avec son équation bilan). 1 pt
1-4-On donne \(pKa(NH_4^ + /N{H_3}) = 9,2\) et \(pKa({C_6}{H_5}COOH/\) \({C_6}{H_5}CO{O^ - }) = 4,2\)
Identifier l’acide faible le plus fort et la base faible la plus forte. 1 pt
1-5-Répondre par vrai ou faux en se servant juste des numéros. 2pt
1-5.1- Un centre électrophile est un site pauvre en électron.
1-5.2- Le groupe caractéristique des amines a une structure plane.
1-5.3- Dans une solution aqueuse d’acide 2-aminopropanoique de \(pH = 7 \); le zwittérion est majoritaire à 25°C.
1-5.4- On appelle configurations d’une molécule les différentes structures spatiales qu’elle peut prendre par suite de rotation autour des liaisons simples.
Exercice 2 : Application directe des savoirs et des savoir-faire / 8 points
2-1- Écrire les formules des acides \(\alpha \)-aminés suivants en notant le (ou les) carbone (s) asymétrique (s) par un astérisque (*).
a) Acide 2-amino-3-méthylpentanoïque. 1 pt
b) Acide 2-amino-3-hydroxybutanoïque. 1 pt
2-2- Nommer les composés suivants selon l’UIPAC. 2 pt 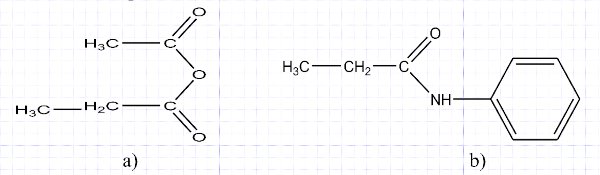 2-3-Indiquer pour chacune des réactions suivantes, la formule semi-développée des composés représentés par les lettres A, B, C, D ,E, F, G, et H 4pt
2-3-Indiquer pour chacune des réactions suivantes, la formule semi-développée des composés représentés par les lettres A, B, C, D ,E, F, G, et H 4pt
2-3-1- Chlorure de propanoyle + A \( \to \) propanoate de méthyle + B
2-3-2- Acide benzoique + \(SOC{l_2}\) \( \to \) \(S{O_2}\)+ \(HCl\) + \(C\)
2-3-3- Ethanoate de propyle + D \( \to \) Ethanoaote de sodium + propan-1-ol
2-3-4- Acide éthanoique + chlorure d'éthanoyle \( \to \) \(E + HCl\)
2-3-5- Chlorure d'éthanoyle + N-méthyléthylamine \( \to \) F + G
2-3-6- H + \({H_2}O\) \( \to \) acide propanoique
Exercice 3 : Utilisation des savoirs et des savoir-faire / 8 points
L'eau oxygénée peut oxyder lentement les ions iodure en milieu acide. Les couples rédox mis en jeu sont \({H_2}{O_2}/{H_2}O\) et \({I_2}/{I^ - }\)
La quantité de diiode formé à un instant \( ? \) peut être déterminée à l'aide d'un dosage.
En effet, le diiode \({I_2}\) peut être réduit par l'ion thiosulfate \({S_2}O_3^{2 - }\)pour régénérer de nouveau \({I^ - }\) . Les couples rédox mis en jeu au cours de la réaction de dosage sont : \({S_4}O_6^{2 - }/{S_2}O_3^{2 - }\) et \({I_2}/{I^ - }\).
1- Écrire l'équation chimique de la réaction d'oxydoréduction qui modélise l'oxydation des ions iodure par l'eau oxygénée. 1pt
2- Écrire l'équation chimique de la réaction d'oxydoréduction au cours de laquelle le diiode formé est réduit en ion iodure. Donner les caractères de cette réaction. 1,5pt
3- Comment peut-on détecter l'équivalence, au cours de ce dosage ? 1pt
4- A l'aide des résultats du dosage du diiode formé à différents instants t par une solution 0,24 mol/L de thiosulfate de potassium \({K_2}{S_2}{O_3}\) il a été possible de tracer la courbe représentant les variations, en fonction du temps, de la quantité d'eau oxygénée \({H_2}{O_2}\) restant dans un système renfermant initialement un mélange en milieu aqueux d'eau oxygénée, d'iodure de potassium et d'acide sulfurique.
a) Calculer la vitesse moyenne de la réaction entre les instants \({t_1} = 2\min \) et \({t_2} = 10\min \). 1pt
b) Déduire graphiquement l'instant \({t_0}\) pour lequel la vitesse instantanée de la réaction est égale à la vitesse moyenne précédemment calculée. Le comparer à \(\frac{{{t_1} + {t_2}}}{2}\). 2pt
c) Déterminer le volume de la solution de thiosulfate de potassium nécessaire pour doser la quantité de diiode formé à l'instant \({t_1}\). 1,5pt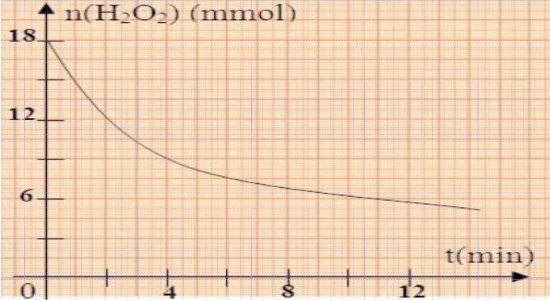
Partie B : Évaluation des compétences / 16 points
Compétence visée : exploiter les résultats d’un dosage acido-basique pour résoudre un problème.
L’acide folique ou vitamine \({B_9}\) est un médicament souvent prescrit aux femmes enceintes pour prévenir les anémies et lutter contre les malformations congénitales.
Suite au phénomène de vente illicite de médicaments contrefaits (dont le principe actif a été substitué ou sous dosé), le Ministre de la santé publique du Cameroun, Dr Manaouda Malachie saisit l’occasion lors de la journée africaine de lutte contre les faux médicaments pour mettre en place, en collaboration avec la douane camerounaise, une brigade chargée de lutter contre ce phénomène. C’est ainsi qu’au cours d’une patrouille, celle-ci saisira un important stock de médicaments d’origine douteuse parmi lesquels la vitamine \({B_9}\) dont le principe actif est l’acide folique et qui est souvent substitué en acide éthanoïque par les trafiquants et dont les conséquences sur la santé de la femme enceinte peuvent être désastreuses.
Afin de s’assurer de la qualité de vitamine \({B_9}\)saisi, cette brigade sollicite les services d’un laboratoire.
Au cours de l’expérience, le technicien de laboratoire décide de procéder par dosage pH-métrique. Pour cela, il dissout un comprimé de ce médicament dans 500mL d’eau. Il prélève ensuite un volume \({V_A} = 2\) mL de cette solution qu’il dose avec une solution d’hydroxyde de sodium \(\left( {N_a^ + ,O{H^ - }} \right)\) de concentration \({C_b} = 2,27 \times {10^{ - 5}}\) ???/? . Les résultats obtenus sont consignés dans le tableau ci-dessous :
| \({V_B}\) (mL) | 0 | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 | 11,0 | 11,5 | 12,0 | 12,5 | 13,0 | 14,0 | 16,0 |
| ?? | 2,1 | 3,2 | 3,6 | 3,9 | 4,2 | 4,6 | 4,9 | 6,3 | 8,0 | 10,7 | 11,0 | 11,3 | 11,5 |
\({V_B}\) é???? ?? ?????? ?? ?′????????? ?? ?????? ????é
NB : le laboratoire dispose de toute la verrerie nécessaire A l’aide de vos connaissances et en utilisant un raisonnement scientifique répondre aux questions suivantes :
A l’aide de vos connaissances et en utilisant un raisonnement scientifique répondre aux questions suivantes :
1- Propose un protocole expérimental permettant d’établir le tableau ci-dessus. 8pt
2- Prononce-toi sur la qualité du médicament 8pt



