Partie A : Évaluation des ressources : 24 points
Exercice 1 : Vérification des savoirs : 8pts
1. Définir : Catalyse homogène ; Monobase forte. 2 pt
2. Une solution donc le pH varie peu par ajout modéré d’acide, de base ou d’eau est : 1 pt
a) Une solution d’acide fort ;
b) Une solution tampon ;
c) Une solution de base faible
3. La réaction d’une amine tertiaire sur un dérivé halogéné conduit à la formation : 1pt
a) D’un anhydride d’acide ;
b) D’un sel d’ammonium quaternaire ;
c) D’un chlorure d’acyle
4. La réaction inverse de l’hydrolyse des esters est la réaction d’estérification VRAI ou FAUX ? 1pt
5. L’oxydation ménagée d’un alcool primaire, l’oxydant étant en défaut conduit à la formation d’un acide carboxylique. VRAI ou FAUX ? 1pt
6. L’opération qui permet de stopper l’évolution d’une réaction en trempant le milieu réaction dans un bain d’eau glacée est appelée : 1pt
a) L’étalonnage ;
b) la trempe de prise d’essai ;
c) le relargage ;
d) le dosage
7. Une amine tertiaire de formule générale \({R_3}N\) est un réactif : 1pt
a) Nucléophile ;
b) Électrophile ;
c) Acide
Exercice 2 : Application des savoirs : 8pts
1. On fait réagir la triéthylamine \({({C_2}{H_5})_3}N\) sur le chlorométhane \(C{H_3} - Cl\)
1.1 Écrire l’équation-bilan de cette réaction. 1pt
2. On considère deux espèces acides notées \(H{A_1}\) et \(H{A_2}\), les solutions \({S_1}\) et \({S_2}\) des deux espèces ont pour concentrations \({C_0} = 0,01mol/L\)
La mesure du pH à 25°C, en utilisant un volume V = 200 mL de chacune des deux solutions \({S_1}\) et \({S_2}\), permet de calculer leurs concentrations en ions oxoniums :
\({\left[ {{H_3}{O^ + }} \right]_1} = 1,3 \times {10^{ - 3}}mol/L\) et \({\left[ {{H_3}{O^ + }} \right]_2} = 1,0 \times {10^{ - 2}}mol/L\)
2.1 Calculer les quantités de matière en ion oxonium \({n_{{{({H_3}{O^ + })}_1}}}\) et \({n_{{{({H_3}{O^ + })}_2}}}\) dans chaque solution. 1pt
2.2 Calculer la quantité de matière d’acide \(H{A_1}\) et \(H{A_2}\), initialement présente dans les 200 mL de chaque solution avant toute réaction avec l’eau. 1 pt
2.3 Des deux acides \(H{A_1}\) et \(H{A_2}\), quel est l’acide fort ? 1pt
3. On mélange à un volume \({V_a}\) d’une solution de chlorure d’ammonium (\(N{H_4}Cl\)) de concentration \(Ca = 0,06mol/L\), un volume \({V_b}\) d’une solution d’hydroxyde de sodium (\(NaOH\)) de même concentration de façon à obtenir 150 ml d’une solution de pH = 9,2.
3.1 Comment appelle-ton ce type de solution ? 1pt
3.2 Donner une importance de cette solution. 0,5pt
3.3 Déterminer les volumes \({V_b}\) et \({V_a}\) nécessaires à la préparation de cette solution. 1,5pt
On donne \(pK{a_{NH_4^ + /N{H_3}}} = 9,2\)
4. La molécule ci-dessous représentée possède combien d’énantiomères ? Justifier votre réponse 1pt
Exercice 3 : Utilisation des savoirs : 8pt
Dans le but de comparer la réaction de l’acide butanoique \(C{H_3}C{H_2}C{H_2}COOH\) et de l’anhydride butanoique \(C{H_3}C{H_2}C{H_2}COOO\) \(CC{H_2}C{H_2}C{H_3}\) sur l’éthanol \(C{H_3}C{H_2}OH\), on réalise séparément deux expériences à la même température :
• Lors de la première expérience : On introduit dans un ballon une quantité \({n_o} = 0,3mol\) d’éthanol, la même quantité \({n_o}\) d’aide butanoique et quelques gouttes d’acide sulfurique concentré \({H_2}S{O_4}\); puis on chauffe à reflux le mélange. Une réaction d’estérification se produit.
• Lors de la deuxième expérience : On introduit dans un autre ballon une quantité \({n_o} = 0,3mol\) d’anhydride butanoique et la même quantité \({n_o}\) d’éthanol, puis on chauffe à reflux la mélange. Une réaction chimique se produit.  Les courbes (1) et (2) du document à remettre avec sa copie de la figure 1 représentent respectivement, l’évolution dans le temps de la quantité de matière \(n\) du produit organique qui se forme lors de la première et de la deuxième expérience.
Les courbes (1) et (2) du document à remettre avec sa copie de la figure 1 représentent respectivement, l’évolution dans le temps de la quantité de matière \(n\) du produit organique qui se forme lors de la première et de la deuxième expérience.
1. Quel est l’intérêt du chauffage à reflux ? 1pt
2. Pour chacune des expériences ci-dessus décrite, déterminer le temps de demi-réaction \({\tau _1}\) et \({\tau _2}\). En déduire la réaction la plus rapide. 3pt
3. Pour chaque expérience ci-dessus décrite, déterminer le rendement de la réaction \(R{d_1}\) et \(R{d_2}\). En déduire laquelle des deux réactions chimiques est totale. 3pt
4. Écrire l’équation-bilan de la réaction qui se produit lors de la deuxième expérience. 1pt
Partie B : Évaluation des compétences : 16 pts
Situation problème :
Sur l’emballage d’un détartrant pour caféine contenant de l’acide sulfamique de formule brute \(N{H_2} - S{O_3}H\), monoacide que l’on pourra noter \(AH\), on peut lire que le degré de pureté en acide sulfamique est de 80 %.
Votre oncle achète un sachet de se détartrant et vous l’apporte dans votre laboratoire ou vous exercez comme laborantin, en vue de s’assurer de la pertinence de l’information ainsi portée.
Pour réaliser ce travail, vous introduisez dans un bécher contenant de l’eau distillée, m = 0,26 g de détartrant et vous suivez au pH-mètre l’évolution du pH lors de l’addition d’une solution d’hydroxyde de sodium (\(NaOH\)) de concentration Cb = 0,2 mol/l.
Les résultats obtenus vous ont donné la courbe du document à remettre avec sa copie, V b étant le volume de soude versé. 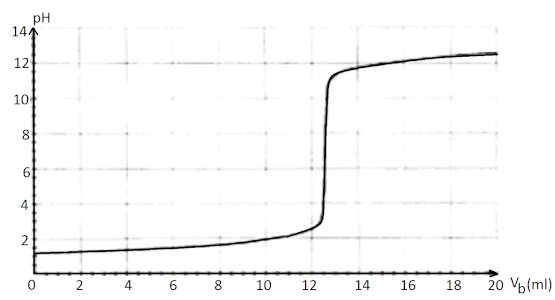 A partir d’une démarche scientifique et après exploitation des données ci-dessus :
A partir d’une démarche scientifique et après exploitation des données ci-dessus :
1 : Décrire le protocole expérimental permettant d’obtenir les valeurs ayant permises de tracer la courbe ci-dessus. 8pt
2 : Dire si l’information marquée sur le sachet de détartrant est fiable. 8pt
On donne en g/mol : S = 32 ; N = 14 ; 0 = 16 ; H = 1


