Partie A : Évaluation des ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1. Définir : Oxydoréduction, alcool. 1 pt
2. Représenter la structure géométrique de la molécule de méthane. 1 pt
3. Donner la différence fondamentale entre chloration et chloruration.
4. Choisir la bonne réponse : 0,5 pt x 4
4.1. Au cours d’une électrolyse, à la cathode il y a toujours
A) oxydation ;
B) réduction ;
C) oxydation et réduction ;
D) aucune réponse.
4.2. L’un des couples des familles des composés ci-dessous présente une isomérie de fonction. Lequel ?
a) Alcène et alcyne;
b) Aldéhyde et Cétone ;
c) Alcane et cyclane.
4.3. Un oxydant est d'autant plus faible que le potentiel du couple auquel il appartient est :
a) Élevé
b) Petit
c) Nul
5. Énoncer la règle de MARKOVNIKOV 1 pt
6- Représenter les deux (02) conformations de cyclohexane 1 pt
Exercice 2 : Applications des savoirs / 8 points
Partie A :
1-Nommer les composés ci-dessous : 1,5 point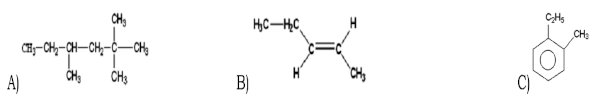 2- Un alcane a pour masse molaire moléculaire 72g/mol. Déterminer sa formule brute. 1 pt
2- Un alcane a pour masse molaire moléculaire 72g/mol. Déterminer sa formule brute. 1 pt
3-Donner tous les isomères possibles d’un alcane de formule C5H12. 1,5 pt
Partie B :
On donne les équations-bilan non équilibrées des réactions d’oxydoréductions suivantes :
a) H{g^{2 + }} + Ag \to Hg + A{g^ + }
b) Hg + A{u^{3 + }} \to Au + H{g^{2 + }}
c) H{g^{2 + }} + Cu \to Hg + C{u^{2 + }}
d) A{g^ + } + Cu \to Ag + C{u^{2 + }}
1- Équilibrer ces équations-bilan 2 pt
2- Établir une classification électrochimique qualitative des couples intervenants dans ces différentes équations. 2 pt
Exercice 3 : Utilisation des savoirs / 8 points
1. Dans un laboratoire, les élèves d’une classe de Première scientifique désirent réaliser la nitration du benzène. Pour cela, ils exécutent le mode opératoire consigné sur la fiche de travaux pratiques suivante :
But de la manipulation : Synthétiser le mononitrobenzène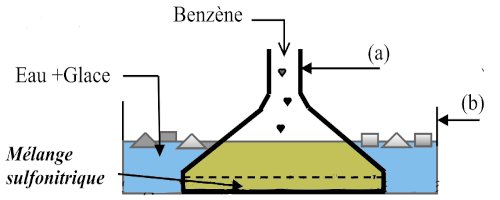 On ne verse goutte à goutte 10cm3 de benzène dans 15cm3 de mélange sulfonitrique ; puis on refroidit le tout avec de l’eau glacée.
On ne verse goutte à goutte 10cm3 de benzène dans 15cm3 de mélange sulfonitrique ; puis on refroidit le tout avec de l’eau glacée.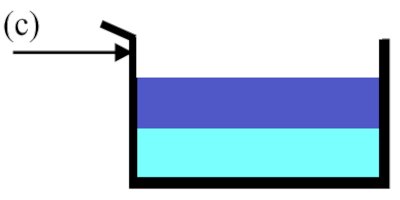 On transvase ensuite le contenu de l’élément (a) dans l’élément (c) ; on agite et on laisse reposer. Il se forme deux phases.
On transvase ensuite le contenu de l’élément (a) dans l’élément (c) ; on agite et on laisse reposer. Il se forme deux phases.
NB : Maintenir la température du milieu réactionnel au dessous de 40°C
1.1-Reproduire sur votre feuille de composition l’élément (c) et son contenu ; 0,75 pt
1.2-Indiquer sur ce schéma la position, la couleur, la nature de chaque phase ainsi que les noms des produits qui se forment. 2 pt
1.3-Écrire l’équation bilan de la nitration ainsi réalisée. 0,75 pt
1.4-Après séparation et pesage, la masse de mononitrobenzène obtenue est 11,2g. Calculer le rendement de cette réaction. 1 pt
On donne : masse volumique du benzène \mu = 880kg/{m^3}; C :12 ; O :16 ; N :14 ; H :1 en g/mol.
2-L'on dissout dans une fiole jaugée de volume 250mL, une masse m = 2,8 g de sulfate de fer (II) solide de formule FeS{O_4} \times {H_2}O. Puis on prélève 40mL de cette solution que l'on place dans un erlenmeyer, à laquelle on ajoute une quantité suffisante d'acide sulfurique. On dose la solution obtenue à l'aide d'une solution de permanganate de potassium de concentration {C_0} = 2 \times {10^{ - 2}}mol/L
2.1- Faire un schéma annoté du dispositif utilisé pour réaliser ce dosage. 1 pt
2.2- Déterminer la concentration de la solution de sulfate de fer (II) sachant que pour atteindre le point équivalent, l'on a versé un volume V0 = 20mL de permanganate de potassium. 1 pt
2.3- En déduire la valeur de l'entier naturel x. 1,5 pt
Partie B : Évaluation des compétences / 16 points
Lors du dernier passage du grand-père BOUSTA à la maison, son petit-fils ASSA lui a fait la promesse de passer les vacances prochaines avec lui au village MIDJIVING. Cette localité est encore très enclavée et dépourvue du réseau électrique.
ASSA vous contacte élève de 1ère C-D pour l’aider à fabriquer à partir des matériels et réactifs disponibles dans le laboratoire de son établissement (voir document 1), des piles possédant une grande f.é.m. qui alimenteront le système d’éclairage qu’il installera chez son grand-père. Il espère ainsi amener son grand-père à abandonner l’usage de deux bougies pour éclairage durant chaque période de la prière du soir.
La chambre sera éclairée exclusivement pendant la période de prière (18h à 20h) tous les soirs durant les trente jours du séjour de ASSA. Quatre lampes seront suffisantes pour éclairer la chambre normalement durant ce séjour.
DOCUMENT 1
Matériels et produits
• Voltmètre, milliampèremètre.
• Béchers, électrodes en Zinc, plomb, Argent
• Ampoules de très faible résistance.
• Des solutions molaires de : sulfate de nickel, sulfate de plomb, sulfate de cuivre, sulfate de zinc, sulfate d’argent.
• Papier filtre, eau distillée.
Document 2
Données disponibles
{E^o}(Z{n^{2 + }}/Zn) = - 0,76V, {E^o}(P{b^{2 + }}/Pb) = - 0,13V, {E^o}(A{g^{ + }}/Ag) = 0,80V
Tension normale de la batterie 4,68 V, cout d’une bougie 125 F, prix de revient d’une pile 250 F, durée de vie d’une pile en fonctionnement 10h, coût des accessoires pour installation électrique 2150 F, coût d’une ampoule 150 F.
1. En vous référant au document 2 ci-dessus, proposer la démarche appropriée pour réaliser le projet de ASSA. 8 points
2. Au terme de l’agréable séjour de ASSA à MIDJIVING, prononcez-vous sur le choix à opérer par son grand-père entre la continuité de l’usage des bougies durant ses prières et l’adoption de l’usage de l’installation électrique réalisée par ASSA. 8 points


