Partie A : Évaluation des ressources / 24 points
Exercice 1 : Vérification des Savoirs / 8 points.
1- Définir les termes suivants : réaction de polymérisation; composé aromatique. 2 pt
2- Écrire la formule générale des alcènes en fonction du nombre \(n\) d’atomes de carbone.1 pt
3- Énoncer la règle de Markovnikov. 2 pt
4- Nommer le groupe fonctionnel présent dans la structure des alcools. 1 pt
5- Répondre par vrai ou faux aux affirmations suivantes :
5-1- La molécule de benzène est plane. 1 pt
5-2- La molécule de cyclohexane présente une conformation dite bateau. 1 pt
Exercice 2 : Application des savoirs / 8 points
1- Nommer les composés suivants : 3 pts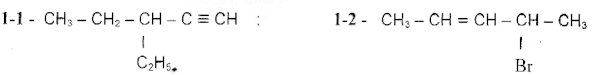 2- On considère l’équation-bilan non équilibrée suivante :
2- On considère l’équation-bilan non équilibrée suivante :
\(A{g^ + } + Sn \to Ag + S{n^{2 + }}\)
2-1- Équilibrer cette équation -bilan en utilisant les nombres d’oxydation. 2 pt
2-2- Préciser en justifiant l’espèce oxydée. 1 pt
3- On donne la représentation conventionnelle d’une pile : \(( - )Zn|Z{n^{2 + }}||A{g^ + }|Ag( + )\)
3-1- Écrire le couple redox intervenant au pôle négatif. 1 pt
3-2- Calculer la fém. E de cette pile. 1 pt
on donne : \({E^o}(Zn|Z{n^{2 + }}) = - 0,76V\) et \({E^o}(A{g^ + }|Ag) = 0,80V\)
Exercice 3: Utilisation des savoirs/ 8 points
1- Dans un laboratoire, un élève veut déterminer par dosage la concentration molaire des ions \(F{e^{2 + }}\) contenus dans une solution de sulfate de fer Il . Il dispose d’une solution decimolaire (\(Co = 0,1\)mol/L ) de permanganate de potassium.
L'équation-bilan de la réaction de dosage est :
\(5F{e^{2 + }} + MnO_4^ - + 8{H_2}{O^ + }\) \( \to 5F{e^{3 + }} + M{n^ + } + 12{H_2}O\)
1-1- Faire un schéma annoté du dispositif à utiliser pour ce dosage. 3 pt
1-2- Déterminer la concentration molaire \(Cr\)des ions \(F{e^{2 + }}\) sachant qu’on a utilisé V= 20 mL de solution sulfate de fer II et que l’équivalence est obtenue pour un volume \({V_0} = 15\) mL versé de la solution de permanganate. 2pt
2- Dans un volume \({V_1} = 25\) mL d’une solution contenant des ions étain (II) \(S{n^{2 + }}\) de concentration \({C_1} = {10^{ - 2}}\) mol/L est ajoute un volume \({V_2}\) d’une solution contenant des, ions cérium (IV) de concentration \({C_2} = {10^{ - 2}}\)mol/L.
L’équation-bilan de la réaction qui a lieu s`écrit :
\(S{n^{2 + }} + 2C{e^{4 + }} \to \) \(S{n^{4 + }} + 2C{e^{3 + }}\)
2-1- Écrire les deux demi -équations correspondantes. 1 pt
2-2- Déterminer le volume \({V_2}\) de la solution d’ions cérium (IV) pour lequel les réactifs ont été mélanges dans les proportions stœchiométriques. . 2 pt
Partie B : Évaluation des compétences/ 16 points
Les membres du club scientifique d’un établissement scolaire ont planifié une excursion dans la région de l’Ouest Cameroun afin de visiter une grotte pittoresque. Pour s’y éclairer, la lampe à acétylène a été choisie (voir figure ci -dessous).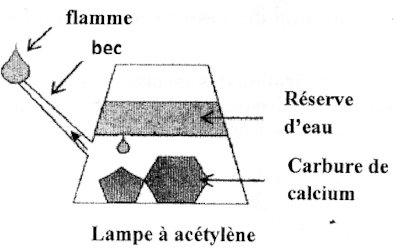 Un groupe d'-élèves, se demandant si le volume de gaz produit par réaction entre le carbure de calcium et l’eau introduits dans la lampe sera suffisant pour assurer l’éclairage durant la visite, se propose de synthétiser en prévision une quantité d’acétylène au laboratoire.
Un groupe d'-élèves, se demandant si le volume de gaz produit par réaction entre le carbure de calcium et l’eau introduits dans la lampe sera suffisant pour assurer l’éclairage durant la visite, se propose de synthétiser en prévision une quantité d’acétylène au laboratoire.
Informations :
Document 1 : Caractéristiques de la lampe ;
• Produit de l’acétylène gazeux \({C_2}{H_2}\) par hydrolyse du carbure de Calcium \(Ca{C_2}\) pur.
• Possède un bec qui brûle 1 L de \({C_2}{H_2}\) en 6 min.
Document 2 :
Quantités de réactifs introduits dans la lampe juste à l’entrée de la grotte :
Carbure de calcium pur : \(Ca{C_2}\) : 48 g
Eau \(\left( {{H_2}O} \right)\) en excès.
Document 3 :
• Durée de la visite : 120 min.
• Accessoires pour la visite:
Allumettes pour déclencher la flamme ;
Chaussures et lunettes de protection, montres, sacs au dos…
On donne en g/rnol les masses molaires moléculaires : \(Ca{C_2}\): 64 ; \({{H_2}O}\): 18.
Le volume molaire des gaz est 24 L/ mol
En utilisant les informations données et a l’aide d’une démarche scientifique,
1- Propose (en t’appuyant sur un schéma annoté) un protocole mis en œuvre par le groupe d’élève pour synthétiser l’acétylène. 6 pt
2- Examine, en t’appuyant sur les caractéristiques de la lampe et les quantités de réactifs introduits, si elle restera allumée ou non durant toute la visite de la grotte. 10 pt



