A. Évaluation des ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1. Réaction de polymérisation : Réaction d'addition de plusieurs molécules insaturées identiques. 1 pt
Composé aromatique : composé organique comportant au moins un noyau benzénique. 1 pt
2. Formule générale des alcènes: CnH2n avec n≥2 1 pt
3. Règle de Markovnikov : Au cours de l’addition d'un composé hydrogéné sur un alcène dissymétrique, l’hydrogène se fixe préférentiellement sur le carbone le plus hydrogéné. 2 pt
4. Nom du groupe fonctionnel présent dans la structure des alcools : groupe hydroxyle. 1 pt
5.1. Réponse: Vrai. 1 pt
5.2. Réponse : Vrai. 1 pt
Exercice 2 : Application des savoirs/ 8 points
1.1. Nom: 3-éthylpent-1-yne ; 1,5 pt
1.2. Nom : 4-bromopent-2-ene. 1,5 pt
2.1. Équilibrage de l’équation-bilan à l’aide des n.o 2 pt x(−I)+y(+II)=0 ⇒x=2y⇒{x=2y=1
x(−I)+y(+II)=0 ⇒x=2y⇒{x=2y=1
D’où 2Ag++Sn→ 2Ag+Sn2+
2.2. Espèce oxydée: Sn (étain) 0,5 pt
Justification : son nombre d'oxydation augmente. 0,5 pt
3.1. Couple redox intervenant au pôle négatif Zn2+/Zn 1 pt
3.2. F.é.m de la pile
E=E0(Ag+/Ag)−E0(Zn2+/Zn)
Exercice 3 : Utilisation des savoirs / 8 points
1.1. Schéma annoté du dispositif de dosage: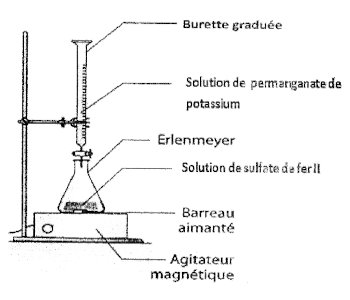 1.3. Concentration molaire Cr : A l’équivalence : nr5=no1⇔CrVr5= CoVo1⇒Cr=5CoVoVr 1 pt
1.3. Concentration molaire Cr : A l’équivalence : nr5=no1⇔CrVr5= CoVo1⇒Cr=5CoVoVr 1 pt
1.4. AN : Cr=0,375molL−1 1 pt
2.1 Deux demi-équations :
{Sn2+→Sn4++2e−Ce4++e−→Ce3+ 0,5 x2 = 1 pt
2.2 Volume de la solution d’ions cérium IV 1 pt
n11=n22⇒V2=2C1V1C2
AN : V2=50 mL
B : Évaluation des compétences / 16 points
1. Protocole mis en ouvre pour synthétiser l’acétylène
Schéma annoté.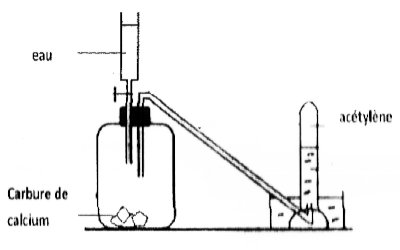 On fait couler de l’eau dans un flacon ou ballon contenant du carbure de calcium solide. Il se forme un gaz (acétylène) recueilli par un dispositif
On fait couler de l’eau dans un flacon ou ballon contenant du carbure de calcium solide. Il se forme un gaz (acétylène) recueilli par un dispositif
2. Examinons si la lampe restera allumée durant la visite :
Démarche :
• Écriture de l'équation-bilan de la réaction entre l’eau et le carbure de calcium ;
• Détermination du volume V1 d'acétylène produit dans la lampe;
• Détermination du volume V0 d’acétylène nécessaire pour la visite (ou bien le temps t, nécessaire pour tout consommer V1)
• Comparaison V1 et V0 (ou t1et tv) où tv est 120 min ;
• Conclusion.
Exécution :
Équation -bilan de la réaction:
CaC2+2H2O→ C2H2+Ca(OH)2
• Déterminons le volume V1 d'acétylène produit dans la lampe :
nCaC2=nC2H2⇔ mCaC2MCaC2=V1Vm
V1=VmmCaC2MCaC2
AN : V1=18L
• Déterminons le volume V0 d'acétylène nécessaire pour la visite (ou bien le temps t1):
En calculant t1 on trouve: t1=18×6=108min
• Comparaison : {V_1} \prec {V_0} ou bien {t_1} \prec {t_v}
Conclusion : la lampe ne restera pas allumée durant toute la visite de la grotte.

