Masses molaires atomiques (g/mol) : C : 12 ; H : 1 ; O : 16 ; N : 14 ; Cr :52 ; K : 39.
EXERCICE 1 : Identification de la verrerie et sécurité au laboratoire / 10 points
1-1-Identification de la verrerie :
Identifier, par leurs numéros, sept (07) éléments de la verrerie ci-contre qui sont nécessaire pour un dosage. 3,5pt 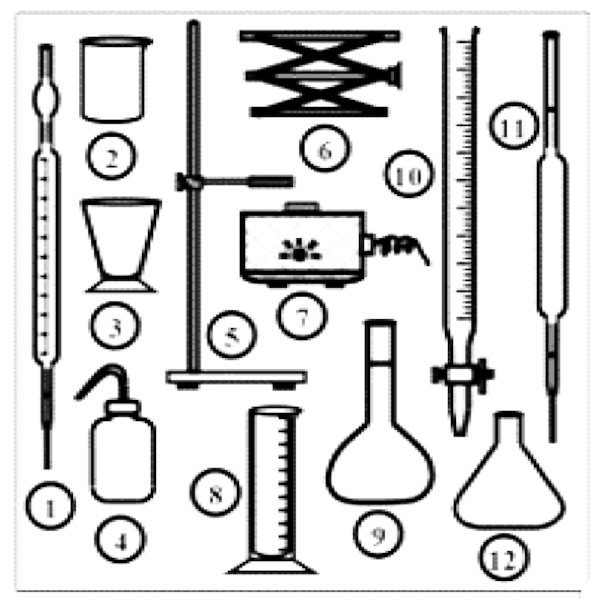 1-2-Sécurité au laboratoire : 6,5points
1-2-Sécurité au laboratoire : 6,5points
Sur l’étiquette de la bouteille de la solution commerciale d’acide sulfurique, on peut lire les indications suivantes :
• Substance dangereuse pour la santé par inhalation, ou par simple contact cutané
• Substance pouvant modifier plus ou moins gravement le bon fonctionnement de l’organisme
• Attaque et ronge les tissus organiques
1-2-1-Donner quatre règles générales de sécurité au laboratoire. 2pt
1-2-2-Donner, en justifiant, trois précautions à prendre pour manipuler ce produit. 3pt
1-2-3-Vous devez étiqueter cette solution, choisissez dans la liste suivante les bons pictogrammes à utiliser pour compléter votre étiquette (utiliser les lettres pour désigner) 1,5pt
Exercice 2 : Préparation d’une solution d’éthylamine / 10 points
On dispose d’une solution S1S1 d’éthylamine de densité par rapport à l’eau d=0,92 et contenant en masse 12% d’éthylamine pure. A l’aide de cette solution on prépare V 2 = 500mL d’une solution S2 de concentration C2 = 0,1mol/L.
2-1-Déterminer la concentration de la solution S1 3pt
2-1-Ecrire l’équation de mise en solution de l’éthylamine C2H5NH2 1pt
2-2-Quel volume V1 de S1 faut-il prélever pour préparer S2? 2pt
2-3-Décrire très clairement le mode opératoire en précisant les différentes quantités de substances utilisées.2pt
2-4-Quel nom donne-t-on à cette méthode de préparation d’une solution ? 1pt
2-5- Si l’éthylamine avait été à l’état solide quel aurait été sa masse ? 1pt
On donne en g/mol les masses molaires MC =12 MH =1 MO =16 M N =14
Masse volumique de l’eau : ρ = 1000 g/L

