Partie A : Évaluation des ressources / 24 pts
Exercice 1 : Vérifications des savoirs/ 8pts
1- Définissons :
Point d’équivalence : C’est le point où les réactifs sont mélangés dans les proportions stœchiométriques au cours de la réaction de dosage. 0,5pt
Mélange racémique : C’est un mélange équimolaire de deux énantiomères. 0,5pt
1-2. QCM : Choisissons la bonne réponse parmi celles proposées ci-dessous : 4x0,5pt
1/b ;
2/b ;
3/a ;
4/c
1-3. Donnons un exemple de réaction lente (avec son équation-bilan) 1 pt
H2O2+2I−+2H2OH2O2+2I−+2H2O →4H2O+I2→4H2O+I2
1-4. Identification : l’acide faible le plus fort est C6H5COOHC6H5COOH et la base faible la plus forte est NH3NH3 car plus le KaKa est grand (pKapKa faible) plus l’acide est fort (plus sa base conjuguée est faible). 2x0,5 pt
1-5. Répondons par vrai ou faux :
1/ Vrai ;
2/Faux (pyramide à base triangulaire) ;
3/Vrai ;
4/Vrai
Exercice 2 : Applications des savoirs / 8pts
2-1. Écrivons les formules des acides αα-aminés suivants en notant le (ou les) carbone (s) asymétrique (s) par un astérisque (*).
a) Acide 2-amino-3-méthylpentanoïque 1pt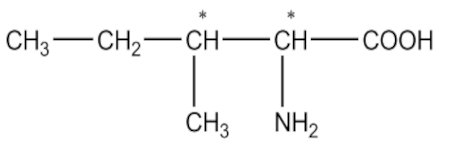 b) Acide 2-amino-3-hydroxybutanoïque 1pt
b) Acide 2-amino-3-hydroxybutanoïque 1pt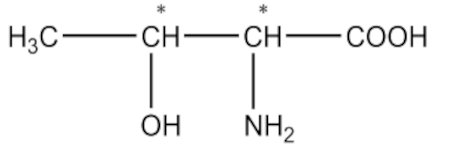 2-2. Nommons les composés suivants selon l’UIPAC.
2-2. Nommons les composés suivants selon l’UIPAC.
a) Anhydride éthanoïque propanoïque 1pt
b) N-phénylpropanamide 1pt
2-3. Indiquons pour chacune des réactions suivantes, la formule semi-développée des composés représentés par des lettres : 8x0,5 pt
A) CH3−OHCH3−OH
B) HClHCl
C) C6H5COClC6H5COCl
D) NaOHNaOH
E) CH3−COOCH2−CH3CH3−COOCH2−CH3
F) CH3−CON(CH3)CH2CH3CH3−CON(CH3)CH2CH3
G) HClHCl
H) CH3−CH2−CO−O−CH3−CH2−CO−O− CO−CH2−CH3CO−CH2−CH3
Exercice 3 : Utilisation des savoirs
3-1- Écrivons l'équation chimique de la réaction d'oxydoréduction qui modélise l'oxydation des ions iodure par l'eau oxygénée : 1 pt
H2O2+2I−+2H3O+H2O2+2I−+2H3O+ →4H2O+I2→4H2O+I2
3-2- Écrivons l'équation chimique de la réaction d'oxydoréduction au cours de laquelle le diiode formé est réduit en ion iodure : 1 pt
2S2O2−3+I2→2S2O2−3+I2→ S4O2−6+2I−S4O2−6+2I−
Cette réaction s’effectue en milieu acide et le diiode est un ampholyte 0,5 pt
3-3- On peut détecter l'équivalence, au cours de ce dosage par le changement de coloration. 1pt
3-4-a) Calculons la vitesse moyenne de la réaction entre les instants t1=2mint1=2min et t2=10mint2=10min:
Vm(H2O2)=−n2−n1t2−t1Vm(H2O2)=−n2−n1t2−t1
AN : Vm(H2O2)=0,75Vm(H2O2)=0,75 mmol/min
b) Déduisons graphiquement l'instant t0t0 pour lequel la vitesse instantanée de la réaction est égale à la vitesse moyenne précédemment calculée : t0=5mint0=5min et comparons à t1−t22=t1−t22= 2+102=6min2+102=6min
Donc t0≺t1−t22t0≺t1−t22
c) Déterminons le volume de la solution de thiosulfate de potassium nécessaire pour doser la quantité de diiode formé à l'instant t1t1.
A t=t1=5mint=t1=5min , nrestant(H2O2)=nrestant(H2O2)= 12mmol=1,2×10−2mol12mmol=1,2×10−2mol alors nreagit(H2O2)=1,8×10−2molnreagit(H2O2)=1,8×10−2mol −1,6×10−2mol=−1,6×10−2mol= 0,6×10−2mol0,6×10−2mol
nH2O2=nI−2⇒nI− =2nH2O2(reagit)= 1,2×10−2mol
nS2O2−3=nI−=1,2×10−2mol
nS2O2−3=CV⇒V =nS2O2−3C=0,05L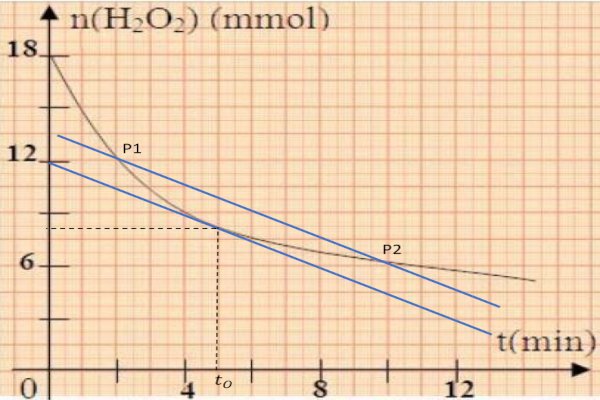
PARTIE B : EVALUATION DES COMPETENCES / 16points
1-Proposons un protocole expérimental permettant d’établir le tableau :
Il est question pour nous ici de décrire le mode opératoire d’un dosage pH-métrique qui é permis de d’établir le tableau des mesures. Pour cela nous allons suivre la démarche suivante :
• Préparer un volume V=500 mL de la solution S de vitamine B9;
• Réaliser le montage du dispositif expérimental ci-dessous ;
• Prélever à l’aide d’une pipette jaugée un volume VA =20 mL de la solution S puis l’introduire dans le bécher
• Introduire la solution d’hydroxyde de sodium dans la burette graduée en prenant soin de fermer le robinet
• Immerger les électrodes du pH-mètre dans la solution du bécher et noter la valeur initiale du pH
• Ajouter, à des intervalles de temps donné, un volume VB de la solution de la burette dans la solution du bécher en prenant soin de mettre l’agitateur magnétique en marche ;
• Noter pour chaque volume VB ajouté, la valeur indiquée par le pH-mètre.
C’est en procédant ainsi, qu’on a obtenu les résultats du tableau donné. 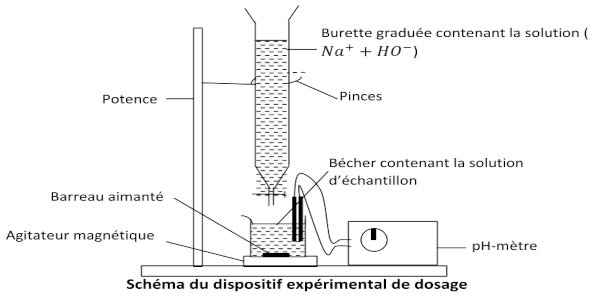 2- Prononçons-nous sur la qualité du médicament :
2- Prononçons-nous sur la qualité du médicament :
Interprétation :
Il est question pour nous ici de chercher le principe actif du médicament étudié et ensuite se prononcer sur la qualité du médicament. Pour cela, nous allons suivre les étapes suivantes :
• Tracer le graphe pH=f(VB) ;
• Exploiter la courbe obtenue pour déterminer le pKa du principe actif contenu dans le médicament
• Comparer le pKa trouvé avec ceux donnés dans le document 3 et en déduire la nature du principe actif ;
Si le principe actif est l’acide folique, vérifier qu’un comprimé contient 5mg de cet acide avant de conclure sur la qualité du médicament ;
-Conclusion : Me prononcer sur la qualité du médicament.
Graphe de la relation pH)=f(VB)
 L’exploitation de cette nous permet de déterminer les coordonnées des points d’équivalence
L’exploitation de cette nous permet de déterminer les coordonnées des points d’équivalence
et de demi équivalence suivants : {? ?? = 12?? ?? ? = 8 et { ???2 = 6??
{VBE=12mLpHE=8 et {VBE2=6mLpHa=4
Ainsi le pKa du principe actif contenu dans le médicament étudié vaut pKa=4
Comparaison : D’après le document 3 nous avons :
• Acide folique : Ka=1,26×10−4⇒ soit pKa=3,9
• Acide éthanoïque : Ka=1,78×10−5⇒ pKa=4,75
Nous constatons que le pKa du principe actif contenu dans le médicament étudié est plus proche de celui de l’acide folique ;
• Calcul de la masse d’acide folique contenu dans un comprimé de ce médicament
Pour 20mL de solution prélevée on a : mAFM=CA×VA⇒ mAF=CA×VAM
?? : mAF=1,2×10−4g
???? un ???????é (??????? ???? 500? ?) ?? ?: mAF=50020×1,2×10−4 =0,03g
Nous constatons qu’un comprimé de ce médicament ne contient que 3mg de principe actif au lieu 5mg
Conclusion :
L’exploitation des résultats de l’expérience a montré que c’est l’acide folique qui est principe actif de la vitamine B9 saisie par la douane mais la quantité du principe actif de cette vitamine n’est pas suffisante : La vitamine B9 saisie est donc un mauvais médicament.

