Partie A : Évaluation des Ressources / 24 points
Exercice I Vérification des savoirs / 8 points
1 - Acide alpha-aminé : composé possédant une fonction acide carboxylique et une fonction amine toutes portées par un même atome de carbone. 2 pt
2-1-Bonne réponse :
2.1 : b) secondaire; 1 pt
2.2 : c) deux énantiomères en quantités égales. 1 pt
3- La réaction d’hydrolyse d’un ester est : lente, athermique et limitée ou réversible. 1x2 = 2 pt
4. Dans l'isomérie de constitution, les isomères diffèrent par leurs formules semi-développées ou développées planes tandis que dans l’isomérie de configuration, les isomères ont la même formule développée ou semi-développées plane mais différent par l’agencement spatial des atomes. 2 pt
Exercice 2 : Application des savoirs / 8 points
1-. Formule brute de l’ester :
\(M = 14n + 32 = 88\) \( \Rightarrow n = \frac{{88 - 32}}{{14}} = 4\) soit \({C_4}{H_8}{O_2}\) 2 pt
2.l. Formules semi-développées des composés 0,5 x 4 = 2 pt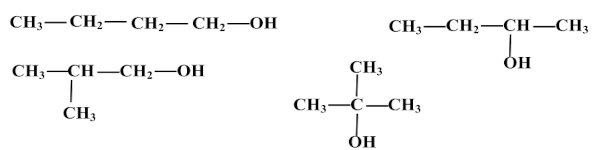 2.2. Nom de l'alcool A : Butan-1-ol. Classe : Alcool primaire. 0,5x2=1 pt
2.2. Nom de l'alcool A : Butan-1-ol. Classe : Alcool primaire. 0,5x2=1 pt
3.1 La molécule est chirale à cause de la présence du carbone asymétrique dans sa structure 1 pt
3.2. Représentation en perspective des deux énantiomères 1 pt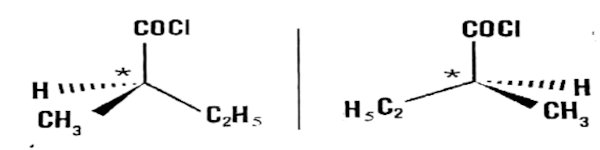 3.3. Équation-bilan : 2 pt
3.3. Équation-bilan : 2 pt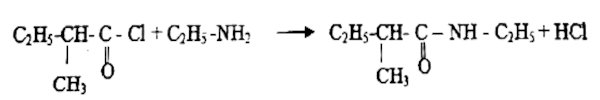
Exercice 3 : Utilisation des savoirs / 8 points
1. Montrer que : \({\left[ {{H_2}{O_2}} \right]_t} = \frac{{5 \times Co \times Vo}}{{2 \times Vp}}\) 2 pt
A l’équivalence on a : \(\frac{{{n_e}}}{5} = \frac{{{n_p}}}{2}\) avec :
\({{n_e}}\) et \({{n_p}}\) les quantités de matière de l’eau oxygénée et de permanganate de potassium. \(\frac{{{n_e}}}{5} = \frac{{{n_p}}}{2} \Rightarrow \frac{{{{\left[ {{H_2}{O_2}} \right]}_t} \times Vp}}{5}\) \( = \frac{{Co \times Vo}}{2}\) soit \({\left[ {{H_2}{O_2}} \right]_t} = \frac{{5 \times Co \times Vo}}{{2 \times Vp}}\)
2. Les prélèvements sont plongés dans le bain de glace pour stopper, bloquer ou arrêter la réaction. 1 pt
3. Courbe 3 pt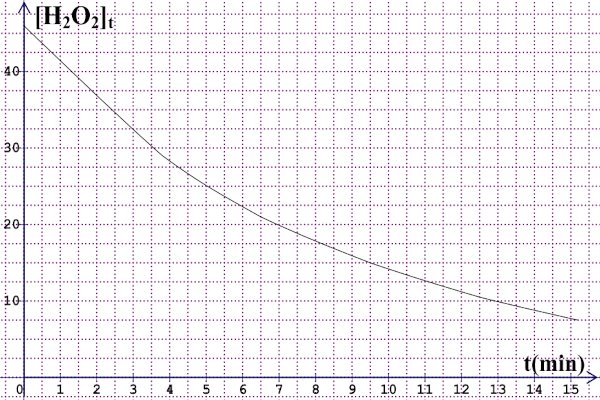 4 Pour les candidats qui ont utilisé \(t = 0\) min et \(t = 9,5\) min 2 pt
4 Pour les candidats qui ont utilisé \(t = 0\) min et \(t = 9,5\) min 2 pt
Vitesse de disparition entre \(t = 0\) min et \(t = 9,5\) min.
\({V_m}\left( {disp} \right) = - \frac{{\Delta \left[ {{H_2}{O_2}} \right]}}{{\Delta t}} = \) \(\frac{{{{\left[ {{H_2}{O_2}} \right]}_{9,5}} - {{\left[ {{H_2}{O_2}} \right]}_0}}}{{9,5 - 0}}\) \( = 3,26 \times {10^{ - 3}}\) mol/L.min.
4- Pour les candidats qui ont utilisé \(t = 0\) s et \(t = 9,5\) s 2 pt
\({V_m}\left( {disp} \right) = - \frac{{\Delta \left[ {{H_2}{O_2}} \right]}}{{\Delta t}} = \) \(\frac{{{{\left[ {{H_2}{O_2}} \right]}_{9,5}} - {{\left[ {{H_2}{O_2}} \right]}_0}}}{{9,5 - 0}}\).
9,5 s = 0,16 min et graphiquement \({\left[ {{H_2}{O_2}} \right]}\) à cet instant vaut \(45 \times {10^{ - 3}}\) mol/L et on trouve \({V_m}\left( {disp} \right) = 6,25 \times {10^{ - 3}}\) mol/L.min
Partie B : Évaluation des compétences / 16 points
I. Protocole :
• Introduire un volume \(V_B\) = 20 mL de la solution de vinaigre dans un bécher :
• Introduire la solution d’hydroxyde de sodium dans la burette
• Plonger les électrodes de pH-mètre préalablement étalonné dans le bécher
• Mettre en marche l’agitateur magnétique;
• Verser progressivement la solution de base forte dans le bécher ;
• Noter chaque fois la valeur du pH indiquée par le pH-mètre correspondant au volume de base versé et cela permettra de tracer la courbe \(pH = f({V_B})\).
• Schéma du dispositif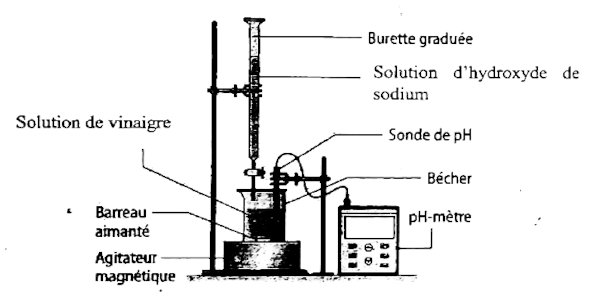
2- Vérification de la conformité du degré du vinaigre.
Actions à mener :
Écrire l’équation-bilan support du dosage ;
Déterminer graphiquement \({V_{BE}}\) ;
Déterminer la concentration d`acide contenu dans l’échantillon dosé ;
En déduire le degré du vinaigre ou pourcentage massique d`acide éthanoïque ;
Comparer à celui porté sur l’étiquette
Conclure.
Résolution
\(C{H_3} - COOH + O{H^ - }\) \( \to C{H_3} - CO{O^ - } + {H_2}O\)
Graphiquement on trouve \({V_{BE}} = 26,8mL\)
NB (accepter le valeurs comprises entre 26, 7 mL et 26,9 mL )
A l’équivalence, on a :
\({n_A} = {n_{H{O^ - }}} \Rightarrow {C_A}{V_A} = \) \({C_B}{V_{BE}} \Rightarrow {C_A} = \frac{{{C_B}{V_{BE}}}}{{{V_A}}}\) \( = 1,34\) mol/L
\(d = 6{C_A} \Rightarrow \) \(d = 6 \times 1,34 = {8,04^o} \approx {8^o}\)
Conclusion : L’indication portée sur l’étiquette est conforme.

