Partie A : Évaluation des ressources / 24 points
Exercice 1 : Vérification des savoirs / 8 points
1- Définir : acide alpha-aminé. 2 pt
2- QCM : Choisir la bonne réponse parmi celles proposées ci-dessous :
2-1- Une cétone est obtenue par oxydation ménagée d’un alcool : 1 pt
a) primaire;
b) secondaire;
c) tertiaire.
2-2- Un mélange est dit racémique lorsqu’il est constitué de : 1 pt
a) deux énantiomères ;
b) deux énantiomères identiques ;
e) deux énantiomères en quantités égales.
3- Donner deux caractéristiques de la réaction d’hydrolyse d’un ester. 2 pt
4- Donner la différence entre l’isomérie de constitution et l’isomérie de configuration. 2 pt
Exercice 2 : Application des savoirs / 8 points
1- Un ester de formule générale CnH2nO2 a une masse molaire M = 88 g/mol.
Déterminer sa formule brute.
Masses molaires en g/mol: C : 12 ; H : 1 ; 0 : 16 1 pt
2- Un alcool A a pour formule brute C4H10O.
2-1- Donner les formules semi-développées des quatre alcools isomères correspondant à cette formule brute. 2 pt
2-2- L’oxydation ménages de l’alcool A aboutit à l’acide butanoïque. Déduire le nom de A et sa classe. 1 pt:
3- Le chlorure de 2-méthylbutanoyle est une molécule de formule : 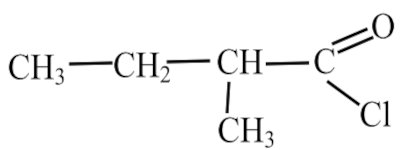 3-1- Justifier que cette molécule est chirale. 1 pt
3-1- Justifier que cette molécule est chirale. 1 pt
3-2- Représenter en perspective les deux énantiomères de cette molécule. 1 pt
3-3- Écrire l’équation-bilan de la réaction entre le chlorure de 2-méthylbutanoyle et l’éthylamine de formule C2H5NH2. 2 pt
Exercice 3 : Utilisation des savoirs / 5 points
La décomposition lente de l’eau oxygénée H2O2 se traduit par 1'équation-bilan :
H2O2→H2O+12O2
Pour étudier la cinétique de cette réaction, ou introduit dans un bécher de l’eau oxygénée et quelques gouttes d’un catalyseur approprié. On effectue des prélèvements de volume Vp = 10 mL du mélange réactionnel qu’on plonge dans un bain de glace puis on dose l’eau oxygénée restante à chaque date par une solution oxydante de permanganate de potassium de
concentration Co=15×10−2mol.L−1. L’équivalence est obtenue à chaque date lorsqu’on a versé un volume Vo de solution de permanganate de potassium.
L’équation-bilan de la réaction du dosage est :
2MnO−4+5H2O2+ 6H3O+→2Mn2++ 5O2+14H2O
1- Montrer que la concentration de la solution en eau oxygénée H2O2 obtenue par dosage dans chaque prélèvement à différentes dates est : [H2O2]t=5×Co×Vo2×Vp 2 pt
2- Dire pourquoi les prélèvements sont plongés dans un bain de glace. 1 pt
3- Les concentrations en eau oxygénée obtenues par dosage dans chaque prélèvement sont contenues dans le tableau suivant :
| t(min) |
0 |
3.8 | 6.5 |
9,5 | 12,5 | 15,2 |
| [H2O2](10−3mol.L−1) | 46 |
29 |
21 |
15 |
10,5 |
7,8 |
Tracer sur le papier millimétré la courbe [H2O2]t=f(t). 3 pt
Échelle : 2 cm pour 10×10−3mol.L−1 et 1 cm pour 1 min. i
4- Déterminer la vitesse moyenne de disparition de Peau oxygénée entre les dates t=0s et t=9,5s. .. 2pt
Partie B : Évaluation des compétences / 16 points
Maman NTOLO a acheté au marché une bouteille de vinaigre pour assaisonner ses salades. Sur l’étiquette de la bouteille est écrit l’indication : degré du vinaigre : d=8o
Son fils ainé, élève en classe de Terminale D se propose d’analyser ce vinaigre afin de vérifier son degré d.
Pour cela, il dose un volume VA=20mL de solution de ce vinaigre par une solution molaire (CB=1mol.L−1) dihydroxyde de sodium (Na++HO−).
Les résultats obtenus lors du dosage ont permis le trace du pH en fonction du volume de base
VB versé. (voir figure ci-dessous).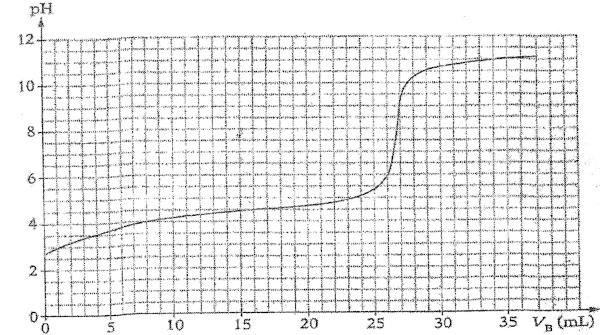 Information 1 : Le vinaigre acheté contient l’acide éthanoïque de formule CH3COOH.
Information 1 : Le vinaigre acheté contient l’acide éthanoïque de formule CH3COOH.
Information 2 : Le degré d du vinaigre est le pourcentage massique d’acide éthanoïque contenu dans le vinaigre et s’exprime par la relation : d=6CA avec CA, la concentration en acide éthanoïque (en moL/L) de la solution du vinaigre.
A partir des informations ci-dessus et à l’aide d’un raisonnement logique,
1 - Propose, schéma à l’appui, un protocole expérimental permettant d’obtenir les mesures qui ont permis de tracer la courbe pH=f(VB) . 8 pt
2 -Vérifie si l’indication ( 8° ) portée sur l’étiquette de la bouteille est conforme. 8 pt
Support : courbe pH=f(VB) obtenue lors du dosage réalisé :


