Partie A : Évaluation des ressources
Exercice 1 :
Questions à Choix Multiples (Q.C.M)
1-b ; 2-d ; 3-c ;
4-b ; 5-b ; 6-b.
Exercice II : Questions à Réponses Ouvertes
- Plasmolyse
- Processus par lequel une cellule végétale perd de l'eau dans une solution hypertonique, entraînant une rétraction du cytoplasme et un détachement de la membrane plasmique de la paroi cellulaire.
- Turgescence
- État d'une cellule végétale lorsqu'elle est pleine d'eau et que la pression interne (pression de turgescence) pousse la membrane plasmique contre la paroi cellulaire, lui donnant une forme rigide.
- Hémolyse
- Destruction des globules rouges (érythrocytes) dans une solution hypotonique, ce qui provoque la rupture de leur membrane cellulaire et la libération de l'hémoglobine dans le plasma..
- Déplasmolyse
- Processus inverse de la plasmolyse où une cellule végétale absorbant de l'eau dans une solution hypotonique se dilate jusqu'à ce que la membrane plasmique touche à nouveau la paroi cellulaire.
- Solution hypotonique
- Solution dont la concentration en soluté est inférieure à celle à l'intérieur de la cellule, provoquant l'entrée d'eau dans la cellule.
- Solution hypertonique
- Solution dont la concentration en soluté est supérieure à celle à l'intérieur de la cellule, provoquant la sortie d'eau de la cellule.
- Osmose
- Mouvement passif de l'eau à travers une membrane semi-perméable, d'une solution de faible concentration en soluté (hypotonique) vers une solution de forte concentration en soluté (hypertonique) jusqu'à atteindre un équilibre.
- Endocytose
- Processus par lequel une cellule ingère des particules ou des liquides en les engloutissant dans des vésicules formées à partir de sa membrane plasmique.
- Exocytose
- Processus inverse de l'endocytose, au cours duquel une cellule expulse des substances contenues dans des vésicules qui fusionnent avec la membrane plasmique pour libérer leur contenu à l'extérieur de la cellule.
- Phagocytose
- Type d'endocytose où une cellule engloutit et digère de grandes particules solides, souvent des débris cellulaires ou des microorganismes, par formation de vésicules.
2. La loi de l'osmose peut être énoncée ainsi :
« L'eau se déplace à travers une membrane semi-perméable d'une région où la concentration en soluté est plus faible (solution hypotonique) vers une région où la concentration en soluté est plus élevée (solution hypertonique), jusqu'à ce que les concentrations de part et d'autre de la membrane soient équilibrées. »
Ce phénomène est un processus passif, c'est-à-dire qu'il ne nécessite pas d'énergie, et il est guidé par le gradient de concentration des solutés dans les deux milieux.
3. Les différences entre le transport actif et le transport passif sont les suivantes :
1. Source d'énergie :
• Transport actif : Nécessite de l'énergie, généralement sous forme d'ATP. Ce type de transport permet de déplacer des molécules contre leur gradient de concentration (de la région la moins concentrée vers la plus concentrée).
• Transport passif : Ne nécessite pas d'énergie. Les molécules se déplacent selon leur gradient de concentration, de la région la plus concentrée vers la moins concentrée.
2. Sens du mouvement :
• Transport actif : Le mouvement des molécules se fait contre le gradient de concentration (de faible concentration à forte concentration).
• Transport passif : Le mouvement des molécules se fait dans le sens du gradient de concentration (de forte concentration à faible concentration).
3. Types de mécanismes :
• Transport actif : Inclut des mécanismes comme les pompes ioniques (exemple : pompe sodium-potassium) et le transport via des vésicules (exemple : endocytose et exocytose).
• Transport passif : Comprend des mécanismes tels que la diffusion simple, la diffusion facilitée (via des protéines de transport), et l'osmose.
4. Exemples :
• Transport actif : Pompe sodium-potassium (Na+/K+), qui fait entrer des ions potassium dans la cellule et expulse des ions sodium en consommant de l'ATP.
• Transport passif : Diffusion de l'oxygène dans les cellules ou diffusion facilitée du glucose via des protéines porteuses.
En résumé, la principale différence réside dans l'utilisation ou non de l'énergie pour le déplacement des molécules et le sens de ce déplacement par rapport au gradient de concentration.
Exercice III
1. Représentons par un dessin précis, une cellule plasmolysée 2. La plasmolyse est due à la perte de l’eau par la cellule.
2. La plasmolyse est due à la perte de l’eau par la cellule.
3. Le milieu intracellulaire est hypotonique ; la solution extracellulaire est hypertonique.
4. Car ces cellules sont naturellement colorées, ce qui facilite leur observation microscopique.
5. Construisons le graphique représentant le nombre de cellules plasmolysées en fonction de la concentration de la solution de saccharose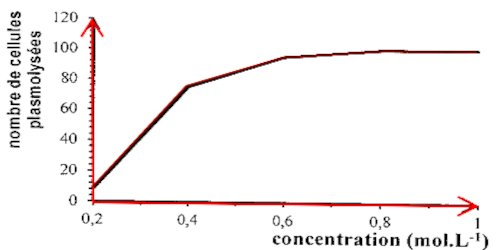 6 - Le taux de cellule plasmolysées croit avec la concentration de la solution et se stabilise à 0,8 mol/L. La croissance s’explique par le fait que plus le milieu le milieu est hypertonique, plus les cellules perdent de l’eau. La stabilité de la courbe s’explique par le fait que toutes les cellules sont plasmolysées
6 - Le taux de cellule plasmolysées croit avec la concentration de la solution et se stabilise à 0,8 mol/L. La croissance s’explique par le fait que plus le milieu le milieu est hypertonique, plus les cellules perdent de l’eau. La stabilité de la courbe s’explique par le fait que toutes les cellules sont plasmolysées
7. Car, ces cellules n’ont pas toutes la même concentration
8 . Calculons la pression osmotique moyenne des cellules de l’échantillon,
\((P.O) = T \times K \times \alpha \) (en atmosphère) = (237+27)x0,082x0,3= 0,73 atmosphère
Exercice IV
1. Comportement des cellules d'épiderme d'oignon dans les solutions a, b et c
Solution a : concentration = 2 g/mol
• Comportement : Les cellules d'épiderme d'oignon vont gagner de l'eau.
• Justification : La solution est hypotonique par rapport à la concentration interne de 4 g/mol des cellules d'oignon. L'eau entre dans les cellules pour équilibrer les concentrations, provoquant la turgescence.
Solution b : concentration = 4 g/mol
• Comportement : Les cellules d'épiderme d'oignon resteront stables.
• Justification : La solution est isotonique par rapport à la concentration interne des cellules d'oignon. Aucun mouvement net d'eau n'a lieu puisque les concentrations sont égales des deux côtés de la membrane.
Solution c : concentration = 12 g/mol
• Comportement : Les cellules d'épiderme d'oignon vont perdre de l'eau.
• Justification : La solution est hypertonique par rapport à la concentration interne de 4 g/mol des cellules d'oignon. L'eau quitte les cellules pour équilibrer les concentrations, provoquant la plasmolyse.
2. Comportement de la cellule de la solution c placée dans de l’eau pure
a) La cellule, placée dans l'eau pure, va gagner de l'eau rapidement. b) Ce phénomène est appelé la déplasmolyse. L'eau entre dans la cellule, qui était précédemment plasmolysée, provoquant une expansion jusqu'à ce que la turgescence soit atteinte.
3. Comportement des hématies (concentration 5 g/mol) dans les solutions a, b et c
Solution a : concentration = 2 g/mol
• Comportement : Les hématies vont gagner de l'eau et peuvent éclater.
• Justification : La solution est hypotonique par rapport à la concentration interne des hématies. L'eau entre dans les hématies, provoquant l'hémolyse.
Solution b : concentration = 4 g/mol
• Comportement : Les hématies resteront stables.
• Justification : La solution est légèrement hypotonique, mais proche de l'isotonie, donc peu de changement net.
Solution c : concentration = 12 g/mol
• Comportement : Les hématies vont perdre de l'eau et rétrécir.
• Justification : La solution est hypertonique par rapport à la concentration interne des hématies. L'eau quitte les hématies, provoquant leur crénation.
4. Différence observée entre les hématies et les cellules d'épiderme d'oignon dans la solution c
Différence : Les hématies subiront une crénation (elles se ratatineront), tandis que les cellules d'épiderme d'oignon subiront une plasmolyse.
• Justification : Les cellules végétales (oignon) ont une paroi cellulaire rigide qui maintient leur forme même en cas de perte d'eau, alors que les hématies, qui n'ont pas de paroi cellulaire, se ratatinent sous l'effet de la perte d'eau.
Évaluation des compétences
Exercice I
1. Calculons la concentration molaire de chaque solution.
Elle est égale à la concentration massique divisée par la masse molaire
• Pour la solution 1, n = 70/342 = 0,204 mol/L ;
• Pour la solution 2, n = 105/342 = 0,307 mol/.L.
2 - La pression osmotique de la vacuole normale doit être intermédiaire à celles des deux milieux expérimentaux
• Pour la solution 1, P.O = (273 + 20) x 0,082 x 0,204 = 49,01 atmosphères ;
• Pour la solution 2, P.O = (273 + 20) x 0,082 x 0,307 = 73,75 atmosphères
Pour estimer la pression osmotique (P.O.) de la vacuole, nous allons utiliser la solution isotonique, qui correspond à la concentration de la vacuole, c'est-à-dire celle où les cellules restent normales (isotoniques).
La solution isotonique se situe entre les concentrations des solutions de 70 g/L et de 105 g/L, car :
• À 70 g/L (0,2047 mol/L), les cellules sont turgescentes (solution hypotonique).
• À 105 g/L (0,3070 mol/L), les cellules sont plasmolysées (solution hypertonique).
La concentration isotonique se trouve donc entre ces deux valeurs, et pour l'estimer, on prend la moyenne des concentrations molaires de ces solutions :
\({\alpha _{isotonique}} = \) \(\frac{{0,204 + 0,3.7}}{2}\) \( = 0,255\) mol/L
\(P.O = 293 \times 0,82 \times \) \(0,255 = 61,56\) atmosphères
La pression osmotique (P.O.) de la vacuole des cellules végétales à 20°C est estimée à environ 61,56 atm.
3. a) Solution 1 →Solution 3 → Solution 2
b) Justification :
• Solution 1 (cellules plasmolysées) : La solution est hypertonique par rapport à la concentration interne des cellules. Les cellules perdent de l'eau et se contractent.
• Solution 3 (cellules normales) : La solution est isotonique. Il n'y a pas de mouvement net d'eau.
• Solution 2 (cellules turgescentes) : La solution est hypotonique. L'eau entre dans les cellules, les rendant turgescentes.
Exercice II
1. Calcul de la pression osmotique des solutions
Nous allons calculer la pression osmotique des deux solutions : celle de \(NaCl\) à 8,7 g/L et celle de glucose à 27 g/L, et en déduire la pression osmotique du plasma sanguin.
1.1. Solution de \(NaCl \) à 8,7 g/L
• Masse molaire du \(NaCl\) (chlorure de sodium) :
Masse molaire \(NaCl=23+35 = 58\) g/mol
Masse molaire \(NaCl=23+35=58 \)g/mol
• Concentration molaire de la solution de \(NaCl\) :
\({\alpha _{NaCl}} = \frac{{8,7}}{{58}} = 0,15\) mol/L
\(P.O = 310 \times 0,82 \times \) \(0,30 = 7,62\) atmosphères
1.2. Solution de glucose à 27 g/L
• Masse molaire du glucose \({C_6}{H_{12}}{O_6}\)
Masse molaire glucose=(6×12)+(12×1)+(6×16)=180 g/mol
• Concentration molaire de la solution de glucose :
• \({\alpha _{glucose}} = \frac{{27}}{{180}} = 0,15\) mol/L
• \(P.O = 310 \times 0,82 \times \) \(0,15 = 3,81\) atmosphères
1.3. Pression osmotique du plasma sanguin
Les deux solutions (NaCl et glucose) sont dites physiologiques, car elles présentent les mêmes caractéristiques osmotiques que le plasma sanguin. Donc, la pression osmotique du plasma sanguin est environ 3,81 atm.
2. Injection des solutions dans l'organisme
Les solutions de NaCl à 8,7 g/L et de glucose à 27 g/L peuvent être injectées dans l'organisme car elles sont isotoniques par rapport au plasma sanguin. Cela signifie qu'elles ont la même pression osmotique que le plasma sanguin, évitant ainsi les mouvements d'eau excessifs vers ou depuis les cellules sanguines, ce qui prévient les risques de lyse (éclatement) ou de crénation (rétrécissement) des hématies.
3. Comportement des hématies dans d'autres solutions de glucose
3.1. Solution de glucose à 10 g/L
• Concentration molaire :
• \({\alpha _{glucose}} = \frac{{10}}{{180}} = 0,056\) mol/L
Cette concentration est inférieure à celle du plasma sanguin (isotonique à environ 0,15 mol/L). Donc, la solution est hypotonique.
• Comportement des hématies : Les hématies vont absorber de l'eau par osmose, car l'eau va entrer dans les cellules (milieu hypotonique) pour équilibrer la différence de concentration. Cela peut entraîner leur turgescence, et si l'osmose continue, elles peuvent éclater dans un phénomène appelé hémolyse.
3.2. Solution de glucose à 60 g/L
• Concentration molaire :
• \({\alpha _{glucose}} = \frac{{60}}{{180}} = 0,33\) mol/L
Cette concentration est supérieure à celle du plasma sanguin, donc la solution est hypertonique.
• Comportement des hématies : Les hématies vont perdre de l'eau par osmose, car l'eau va sortir des cellules (milieu hypertonique) pour équilibrer la concentration extérieure. Cela provoquera leur plasmolyse (rétrécissement des hématies).
Conclusion :
• Une solution hypotonique (ex. glucose 10 g/L) provoque l'hémolyse des hématies.
• Une solution hypertonique (ex. glucose 60 g/L) provoque leur plasmolyse.
• Les solutions isotoniques (NaCl 8,7 g/L, glucose 27 g/L) maintiennent les hématies dans un état stable.
Exercice III
1 - Le volume vacuolaire diminue de 0 à 15 min, puis augmente de 15 à 40 min et se stabilise à sa valeur initiale
2 - Cette cellule perd de l’eau (plasmolyse) au début de l’expérience, puis gagne de l’eau (déplasmolyse) par la suite
3 - La cellule perd de Peau, car au début de l’expérience sa concentration est inférieure à celle de la solution ; elle gagne par la suite de l’eau, car sa concentration est supérieure à celle de la solution
4 - La pression osmotique augmente au début de l’expérience, puis diminue et retrouve sa valeur initiale
5 -Dans la nature, les cellules végétales sont généralement turgescentes car elles se trouvent souvent dans un milieu hypotonique par rapport à leur vacuole. Cela signifie que l'eau extérieure est plus concentrée en eau (moins en soluté), et entre donc dans la cellule par osmose.
La turgescence est bénéfique pour les plantes car elle :
Maintient la rigidité des tissus végétaux, permettant aux plantes de rester droites et d'optimiser l'exposition à la lumière pour la photosynthèse.
Soutient la croissance cellulaire en créant une pression interne contre la paroi cellulaire, stimulant ainsi l'expansion des cellules.

