Partie A : Évaluation des Ressources / 24 points
Exercice I Vérification des savoirs / 8 points
1 - Acide alpha-aminé : composé possédant une fonction acide carboxylique et une fonction amine toutes portées par un même atome de carbone. 2 pt
2-1-Bonne réponse :
2.1 : b) secondaire; 1 pt
2.2 : c) deux énantiomères en quantités égales. 1 pt
3- La réaction d’hydrolyse d’un ester est : lente, athermique et limitée ou réversible. 1x2 = 2 pt
4. Dans l'isomérie de constitution, les isomères diffèrent par leurs formules semi-développées ou développées planes tandis que dans l’isomérie de configuration, les isomères ont la même formule développée ou semi-développées plane mais différent par l’agencement spatial des atomes. 2 pt
Exercice 2 : Application des savoirs / 8 points
1-. Formule brute de l’ester :
M=14n+32=88M=14n+32=88 ⇒n=88−3214=4 soit C4H8O2 2 pt
2.l. Formules semi-développées des composés 0,5 x 4 = 2 pt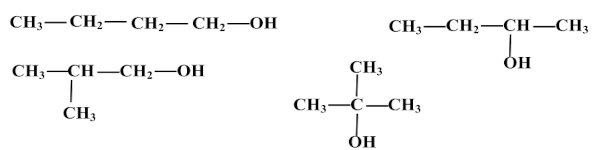 2.2. Nom de l'alcool A : Butan-1-ol. Classe : Alcool primaire. 0,5x2=1 pt
2.2. Nom de l'alcool A : Butan-1-ol. Classe : Alcool primaire. 0,5x2=1 pt
3.1 La molécule est chirale à cause de la présence du carbone asymétrique dans sa structure 1 pt
3.2. Représentation en perspective des deux énantiomères 1 pt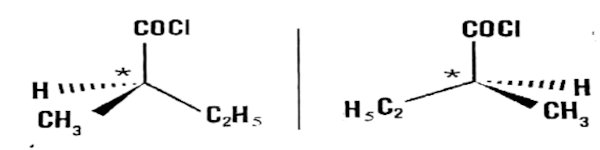 3.3. Équation-bilan : 2 pt
3.3. Équation-bilan : 2 pt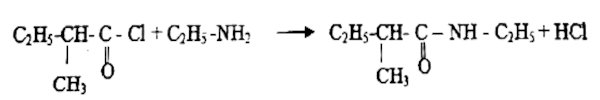
Exercice 3 : Utilisation des savoirs / 8 points
1. Montrer que : [H2O2]t=5×Co×Vo2×Vp 2 pt
A l’équivalence on a : ne5=np2 avec :
ne et np les quantités de matière de l’eau oxygénée et de permanganate de potassium. ne5=np2⇒[H2O2]t×Vp5 =Co×Vo2 soit [H2O2]t=5×Co×Vo2×Vp
2. Les prélèvements sont plongés dans le bain de glace pour stopper, bloquer ou arrêter la réaction. 1 pt
3. Courbe 3 pt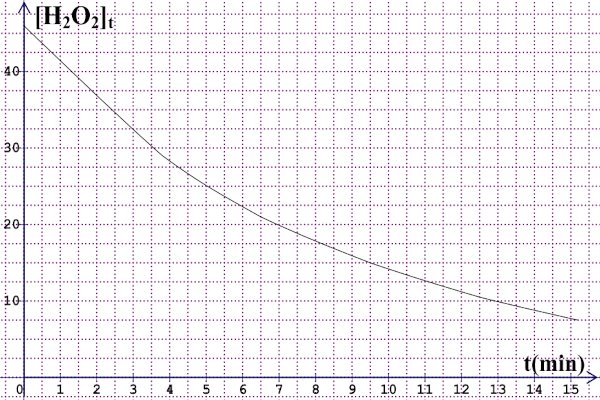 4 Pour les candidats qui ont utilisé t=0 min et t=9,5 min 2 pt
4 Pour les candidats qui ont utilisé t=0 min et t=9,5 min 2 pt
Vitesse de disparition entre t=0 min et t=9,5 min.
Vm(disp)=−Δ[H2O2]Δt= [H2O2]9,5−[H2O2]09,5−0 =3,26×10−3 mol/L.min.
4- Pour les candidats qui ont utilisé t=0 s et t=9,5 s 2 pt
Vm(disp)=−Δ[H2O2]Δt= [H2O2]9,5−[H2O2]09,5−0.
9,5 s = 0,16 min et graphiquement [H2O2] à cet instant vaut 45×10−3 mol/L et on trouve Vm(disp)=6,25×10−3 mol/L.min
Partie B : Évaluation des compétences / 16 points
I. Protocole :
• Introduire un volume VB = 20 mL de la solution de vinaigre dans un bécher :
• Introduire la solution d’hydroxyde de sodium dans la burette
• Plonger les électrodes de pH-mètre préalablement étalonné dans le bécher
• Mettre en marche l’agitateur magnétique;
• Verser progressivement la solution de base forte dans le bécher ;
• Noter chaque fois la valeur du pH indiquée par le pH-mètre correspondant au volume de base versé et cela permettra de tracer la courbe pH=f(VB).
• Schéma du dispositif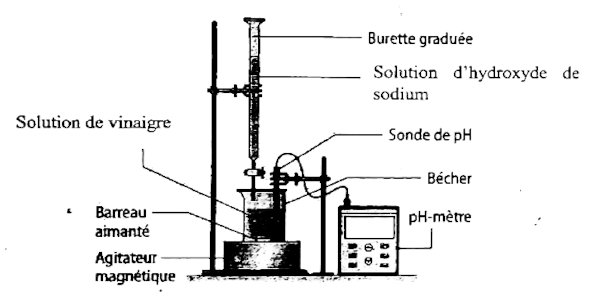
2- Vérification de la conformité du degré du vinaigre.
Actions à mener :
Écrire l’équation-bilan support du dosage ;
Déterminer graphiquement VBE ;
Déterminer la concentration d`acide contenu dans l’échantillon dosé ;
En déduire le degré du vinaigre ou pourcentage massique d`acide éthanoïque ;
Comparer à celui porté sur l’étiquette
Conclure.
Résolution
CH3−COOH+OH− →CH3−COO−+H2O
Graphiquement on trouve VBE=26,8mL
NB (accepter le valeurs comprises entre 26, 7 mL et 26,9 mL )
A l’équivalence, on a :
nA=nHO−⇒CAVA= CBVBE⇒CA=CBVBEVA =1,34 mol/L
d=6CA⇒ d=6×1,34=8,04o≈8o
Conclusion : L’indication portée sur l’étiquette est conforme.



